※叢雲くすり (創薬ちゃん)@souyakuchan様が企画する創薬 (dry) Advent Calendar 2022に参加しております(本記事を12/1枠で投稿)。
※このブログは、医薬品に関連した知財判決やニュースを中心に取り上げています。ご興味あれば、当ブログ(https://www.tokkyoteki.com)とTwitter(@tokkyoteki)のフォローもどうぞよろしくお願いします。
1.はじめに
本記事では、新型コロナウイルス感染症(COVID-19)治療薬へのドラッグ・リポジショニングが行われたファビピラビル(favipiravir)とレムデシビル(remdesivir)の特許出願競争において、オリジネーターである製薬企業が中国人民解放軍軍事科学院(Academy of Military Medical Sciences)の後塵を拝することとなってしまったこと、そして、その中国人民解放軍の特許出願の日本での審査状況を眺めながら、ドラッグ・リポジショニングを事業として成功するために必要な特許的な注意点を紹介します。
2.ドラッグ・リポジショニング
(1)ドラッグ・リポジショニングとは
ドラッグ・リポジショニング(drug repositioning)とは、既存承認薬の有効成分である化合物または開発を中止してしまった化合物を新たな適応症の治療薬として再活用または復活できないか、その可能性を探るための医薬品の研究開発手段です。ドラッグ・リパーパシング(drug repurposing)ともいいます。
その利点は、スペックが明らかとなっている既存の化合物を活用するため、全く新しい化合物を合成展開していく通常の新薬の研究開発に比べて、開発を進めるうえで一定の確実性のもと開発期間の短縮化と開発コストの大幅な削減が期待できることにあります。
(2)特許は悩みの種?
しかし、再活用または復活させる化合物の物質特許に係る特許権は既に満了しているか残存期間が短い場合がほとんどでしょうから、後発医薬品の参入が早期に起きるようであれば将来にわたる事業収益が見込めない可能性がある、という点で、ドラッグ・リポジショニングには大きな課題があります。
そのため、物質特許の存在よりも、リポジショニングで狙う新たな適応症に対する医薬用途発明の特許の取得とその特許権の存続期間の見通しのほうが、開発のgo/no-goの大きなデシジョン要素の一つとなることも多いのではないでしょうか。
特に、臨床試験データ保護(data exclusivity)を目的として薬事制度上付与される、新規有効成分医薬品の非特許独占保護期間(以下、「先発権」という。日本では目的が異なりますが「再審査期間」がそれに当たるとされています。)が、欧州のように8+2年付与されるのであればまだ良いですが、米国のように5年(new chemical entityの場合)しか付与されない、または既存承認薬のリポジショニングであれば新規有効成分医薬品ではないため「先発権」を十分享受できない、あるいは「先発権」のない国もある・・・となると、「特許権」として医薬用途発明の保護が十分であるかどうかがドラッグ・リポジショニングの事業性にとって極めて重要となります。

その医薬用途発明の特許取得失敗は許されない・・・なんて社内の知的財産部門へのプレッシャーが大きなものとなることもある?
その化合物及びその作用メカニズムが既に公に知られているのであれば、その化合物をリポジショニングで狙う新たな適応症に適用しようとすることは、新たな作用メカニズムの発見(それに伴う適応症への新たな広がり)でない限り、その分野の科学者であれば文献調査して容易に思いつく発想であることもあり、その医薬用途発明の特許を取得するために、進歩性(米国では非自明性)の観点が悩みの種となることも多いのではないでしょうか。
そこで、進歩性をしっかり確保するために、主張ロジックや証拠収集、さらには実験データをもっと揃えるために十分な検討期間を経てから特許出願したい・・・かもしれません。
しかし、対象となる有効成分(化合物)が既に公に知られている状況であれば、同じ適応症を狙って研究開発している競合企業等の第三者に特許出願を先んじられるという最悪の結果もあり得ます。
以上のように、ドラッグ・リポジショニンにおいては、事業性に資する特許権を確保できるのか、そのために特許要件である進歩性をクリアできるのか、第三者に先を越されないように研究開発のどのタイミングで出願すべきか、という点を、それぞれの研究開発の状況や競合状況も睨みながら判断し結論を出していく必要があります。
3.ファビピラビルの例
(1)ファビピラビルのドラッグ・リポジショニング
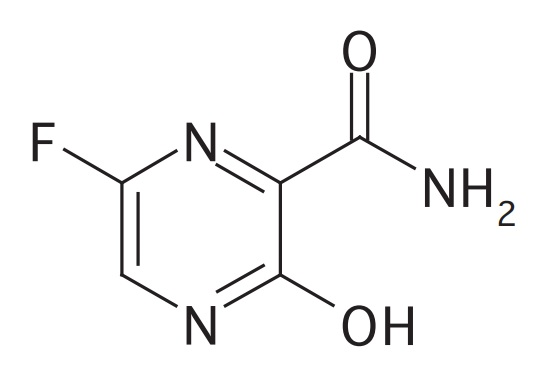 新型コロナウイルス感染症(COVID-19)に対する治療薬としてのドラッグ・リポジショニングが行われたものとしてファビピラビル(favipiravir)があります。
新型コロナウイルス感染症(COVID-19)に対する治療薬としてのドラッグ・リポジショニングが行われたものとしてファビピラビル(favipiravir)があります。
ファビピラビルは、抗インフルエンザウイルス薬「アビガン®」の有効成分として知られています。
富士フイルム富山化学が、ファビピラビルのオリジネーターであり、日本において抗インフルエンザウイルス薬「アビガン®」の製造販売承認を取得しました。
新型コロナウイルス感染症に対してファビピラビルが有効な治療薬になり得るのではないかと世の中が盛り上がりを見せはじめるなか、富士フイルム富山化学は、2020年3月にファビピラビルの新型コロナウイルス感染症に対する治療薬としての開発(国内臨床第III相試験)を開始しました。
しかし、残念ながら、本年10月に、富士フイルム富山化学はその開発を中止すると発表しました(2022.10.14 「抗インフルエンザウイルス薬「アビガン®錠」新型コロナウイルス感染症を対象とした開発の中止について」参照。)。
(2)中国人民解放軍軍事科学院の特許出願
ファビピラビルの新型コロナウイルス感染症治療薬としての可能性を見出して、SARS-CoV-2の感染により引き起こされる疾患治療薬として用いられるファビピラビルに関する発明についての特許出願をいち早く行ったのは、中国人民解放軍軍事科学院(Academy of Military Medical Sciences)でした。
その日本への特許出願は、昨年8月に公開され、現在、特許庁での審査に係属しています。
【公開番号】特開2021-116296
【公開日】2021.08.10
【発明の名称】コロナウイルス感染の治療におけるファビピラビルの使用
【出願番号】特願2020-173044
【出願日】2020.10.14
【優先権主張番号】202010070142.0
【優先日】2020.01.21
【優先権主張国・地域又は機関】中国(CN)
【出願人】アカデミー オブ ミリタリー メディカル サイエンシズ
その経緯は、以下の記事をご参照ください。
- 2020.03.18記事: アビガン®錠(ファビピラビル(favipiravir))の物質特許

この日本の特許出願の特許庁における審査経過は、J-PlatPat(こちら→特開2021-116296)の経過情報から閲覧できます。
審査経過を眺めると、この出願に対して、第三者から幾度も刊行物等提出書による情報提供がされています。ぴたりと審査経過をフォローして登録阻止のために誰かが張り付いているようです。
誰なのかは不明ですが、ファビピラビルを新型コロナウイルス感染症に対する治療薬として開発していた富士フイルム富山化学である可能性は高いと思われます。
中国人民解放軍軍事科学院により特許出願が行われていたにもかかわらず、富士フイルム富山化学がファビピラビルのリポジショニングの開発に突き進んだわけですが、仮に開発が成功していたら、そしてこの特許が成立していたら、その後どのようなことが起きていたのでしょうか。
という点がまさに現実となったドラッグ・リポジショニングの例といえます。
(3)リポジショニングによる医薬用途発明の進歩性
本年10月4日、特許庁審査官から、中国人民解放軍軍事科学院(出願人)に対して、新規性及び進歩性を欠如することを理由にこの発明は特許を受けることはできないとする2度目の拒絶理由通知が発せられました。
この審査は現時点で最終的な結論に至っていませんが、審査官からの拒絶理由通知を眺めると、審査官が考えるドラッグ・リポジショニングにおける医薬用途発明の進歩性のハードルの高さを知ることができます。
その拒絶理由通知(進歩性欠如を説明する部分)の一部を以下に抜粋しました。
なお、短期間に医薬を開発するための手法として、承認済み医薬について他の医薬用途の開発を行う「ドラッグリポジショニング」は、本願出願前に証拠を挙げる必要が無いほどに当業者の技術常識であった。
また、ファビピラビルが抗インフルエンザ薬として日本において承認されていることは、引用文献1(結論欄)及び引用文献2(要約欄)のいずれにも記載されるように周知であった。
さらに、本願優先日前に、既に世界中から注目を浴びるに至っていた新型コロナウイルスに対していち早く治療薬を提供することは、周知の課題であったと言える。
これらを考慮すれば、なおさら、ファビピラビルを、新型コロナウイルス(2019-nCoV)に適用しようとすることは、当業者にとって動機づけられていたと言える。
特許庁審査官からの進歩性欠如の拒絶理由通知を読むと、ドラッグ・リポジショニング一般についての活動には動機付けがあり、進歩性が認められず、特許取得はもう無理なのではないか・・・と、ドラッグ・リポジショニングに取り組む研究者は絶望してしまうかもしれません。
まさに、
ということに直面しているわけです。
しかし、絶望する必要はありません。
「技術常識であったから」、「注目を浴びていたから」、「周知の課題があったから」・・・その発明を思いつくことができた(could)・・・と判断するのではなく、出願当時に公知文献または証拠等に基づいて当業者であれば本当に思いつこうとしたか(would)、挑戦しようとしたことが明らかであったか(obvious to try)が、動機付けの有無についての判断において議論されるべきだと思います。
すべてのリポジショニングへの着想が動機付けられるはずはなく、出願時に既に公に知られていた文献等に、その化合物、作用メカニズム、疾患、それらを関連づける確からしさ、科学的妥当性を示す証拠などがどこまで記載されているかを個別且つ客観的に踏まえたうえで、後知恵バイアスを排除して、検討する必要があることはいうまでもありません。
数ある作用メカニズムの可能性や疾患の複雑な病態の中から互いに関係を繋げるだけの単純な調査結果から、直ちに対象化合物をその疾患へ適用することが容易想到であるとされるものではありませんし、もちろん、それを実証しなければならない研究開発も簡単なものではありません。
今後、出願人である中国人民解放軍軍事科学院の反論に期待したいと思います。
・・・
とはいっても、富士フィルム富山化学によるファビピラビルのリポジショニングは失敗に終ってしまいました。
中国人民解放軍軍事科学院としては、当初、富士フイルム富山化学に対して、

“僕と契約して、◯◯◯◯になってよ!”
とライセンスを与えて(○○○○=実施権者ですね・・・)特許権の実施料を求めるつもりだったのかもしれませんが、ファビピラビルの日本での開発が中止となったことで特許を得る価値は無くなってしまったため、その出願を取り下げるかもしれません。
一方、富士フイルム富山化学(の知財部門)としては、中国人民解放軍軍事科学院が特許を取得してその権利を行使(製造販売行為の差止めや損害賠償を請求)してくることへの不安に怯える必要はなくなったため胸を撫で下ろしている一面はあるかもしれません(開発失敗に安堵するとは不謹慎ですが)。
4.レムデシビルの例
(1)レムデシビルのドラッグ・リポジショニング
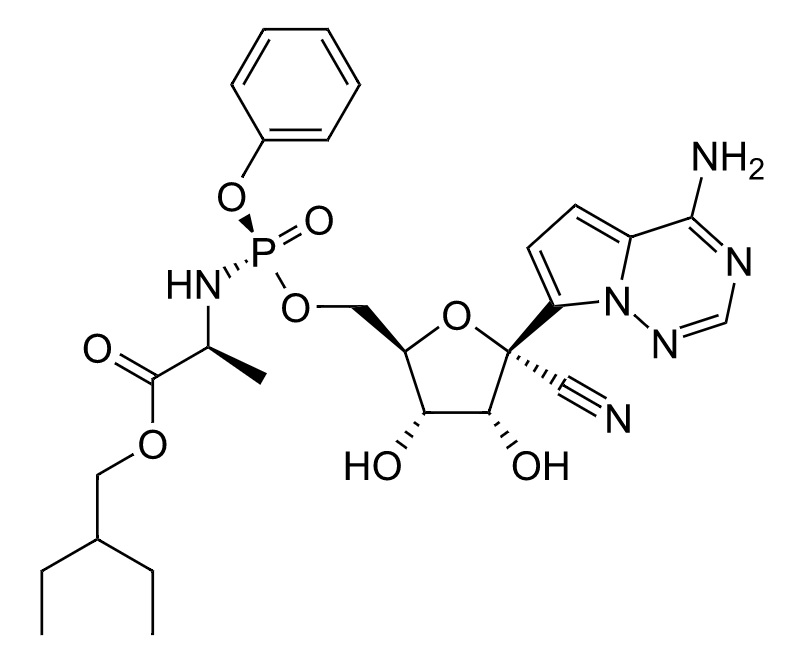 新型コロナウイルス感染症(COVID-19)に対する治療薬としてのドラッグ・リポジショニングが行われたものとしてレムデシビル(remdesivir)があります。
新型コロナウイルス感染症(COVID-19)に対する治療薬としてのドラッグ・リポジショニングが行われたものとしてレムデシビル(remdesivir)があります。
レムデシビルは、当初、エボラウイルスへの抗ウイルス活性を示す新規ヌクレオチドアナログのプロドラッグとしてGilead社が開発を進めていましたが、新型コロナウイルス(SARS-CoV-2)感染症の治療薬として有効であることが見出され、新型コロナウイルス感染症治療薬「ベクルリー®(VEKLURY®)」の有効成分としてGilead社が世界各国で承認を取得しています。
これはドラッグ・リポジショニングの開発成功例です。
(2)中国人民解放軍軍事科学院の特許出願
しかし、レムデシビルの新型コロナウイルス感染症治療薬としての可能性を見出して、SARS-CoV-2の感染により引き起こされる疾患治療薬として用いられるレムデシビルに関する発明についての特許出願をいち早く行ったのは、またしても中国人民解放軍軍事科学院でした。
Gilead社も特許出願(WO2021154687)したものの、その優先日は、中国人民解放軍軍事科学院の出願日(優先日)の何とわずか6日遅れでした。
レムデシビルの新型コロナウイルス感染症治療薬へのリポジショニングも、
という点がまさに現実となった例といえます。
これまでの経緯は、以下の記事をご参照下さい。
- 2020.03.22記事: レムデシビル(Remdesivir)に関連する特許出願について

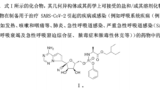
中国人民解放軍軍事科学院による日本への特許出願は、昨年8月に公開され、現在、特許庁での審査に係属しています。
【公開番号】特開2021-116295
【公開日】2021.08.10
【発明の名称】SARS-CoV-2感染の治療における置換アミノプロピオン酸化合物の使用
【出願番号】特願2020-172950
【出願日】2020.10.14
【優先権主張番号】202010071087.7
【優先日】2020.01.21
【優先権主張国・地域又は機関】中国(CN)
【出願人】アカデミー オブ ミリタリー メディカル サイエンシズ
(3)リポジショニングによる医薬用途発明の進歩性
本年10月4日、特許庁審査官から、中国人民解放軍軍事科学院(出願人)に対して、新規性及び進歩性を欠如することを理由にこの発明は特許を受けることはできないとする2度目の拒絶理由通知が発せられました。
特許庁審査官からの拒絶理由通知は、J-PlatPat(こちら→特開2021-116295)の経過情報から閲覧できます。
前述のファビピラビルの審査とほとんど同じスケジュールで審査が進んでいるようです。
その拒絶理由通知(進歩性欠如を説明する部分)の一部を以下に抜粋しました。
引用文献1に記載された所定の化合物が、各種のコロナウイルスに対して広範なスペクトラムの抗ウイルス活性を有する化合物であることが、本願優先日前に当業者の技術常識であったことを踏まえれば・・・(略)・・・、引用文献1において、コロナウイルス科に用いることが記載されている化合物を、引用文献2-4に記載されるように本願優先日前に周知となっていた中国武漢で同定されたウイルス、すなわち、2019-nCoV(SARS-CoV -2の当時の呼称)に対しても用いてみることは当業者が容易に想到し得たことである。
現在、その出願に係る医薬用途発明については、日本だけでなく、同特許出願のファミリーである欧州出願(EP3854403)や米国出願(US 2021-0220377 A1)においても、各特許庁から進歩性/非自明性欠如を指摘されている状況で、欧米でも特許として登録されるかどうかは不透明であり、少なくともその審査は長期化しそうです。
日本だけでなく、欧米でも、
ということに直面しているわけです。
ベクルリー®(VEKLURY®)の2021年の売上は、米国で$3,640m、欧州で$1,095m、グローバルでは$5,565mでした(Gilead Form 10-K Annual report 02/23/2022)。
中国人民解放軍軍事科学院によるレムデシビルの特許出願が特許として登録されたとなれば、Gilead社は、ベクルリー®(VEKLURY®)を販売するにあたって多額の特許実施料を中国人民解放軍軍事科学院に支払わなければならない可能性も出てきます。
Gilead社は、特許権侵害訴訟に発展することを念頭に対抗策の準備を進めながら、審査経過を注視しているに違いありません。
今後も審査経過に注目したいと思います。
5.おわりに
ファビピラビルとレムデシビルを例として、ドラッグ・リポジショニンにおける特許的な注意点をいくつか紹介しました。それら注意点に対しては、研究開発の状況や競合状況に応じて、研究開発部門、事業部門、知的財産部門等で知恵を出しあって解決(時にはリスクテイクして決断)していく必要があります。
ファビピラビルとレムデシビルのドラッグ・リポジショニングは明暗が分かれましたが、その裏では特許出願競争があり、リポジショニングの医薬用途発明の特許取得は困難に直面していました。またオリジネーターではない第三者が特許を取得してしまえば特許紛争の可能性もでてきます。
しかし、それら開発の失敗も成功も競争も全ては、2019年末に発生したパンデミックに対して、ドラッグ・リポジショニングによって早期に治療薬を見つけ出そうとした製薬会社やアカデミアによる迅速かつ果敢な挑戦の証(あかし)であり、それらの挑戦がパンデミック発生当時には有効な治療法がなかった絶望の世界に希望を与えてくれたものであったことを忘れてはならないと思います。
そして、今や、ワクチンや治療薬も次々と開発され、世界中に供給されるに至り、未知のウイルスに戦々恐々としていたパンデミックは終息に向かっています。
もう絶望する必要なんて、ない!




コメント