2022年5月20日、「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律等の一部を改正する法律の施行に伴う関係政令の整備等に関する政令」が公布されました。
本政令は、第208回通常国会において成立した「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律等の一部を改正する法律(令和4年法律第47号)」(以下、「改正薬機法」という。)の施行に伴い、関係政令の整備を行うものであり、特許法施行令についても、特許権の存続期間の延長登録制度(特許法第67条第4項)に関して、延長登録の理由となる処分を定める規定を整備するものです。
- 2022.05.20 特許庁ウェブサイト「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律等の一部を改正する法律の施行に伴う関係政令の整備等に関する政令」より
1.背景
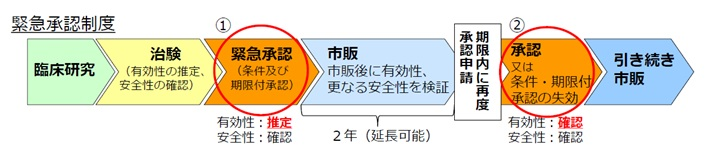
2022年5月20日付で成立し、同日公布・施行された改正薬機法(第14条の2の2等)では、緊急時において、安全性の確認を前提に医薬品等の有効性が推定されたときに、条件及び期限付きの承認を与える迅速な薬事承認の仕組み(第14条の2の2等。以下「緊急承認制度」という。)が新たに設けられました。
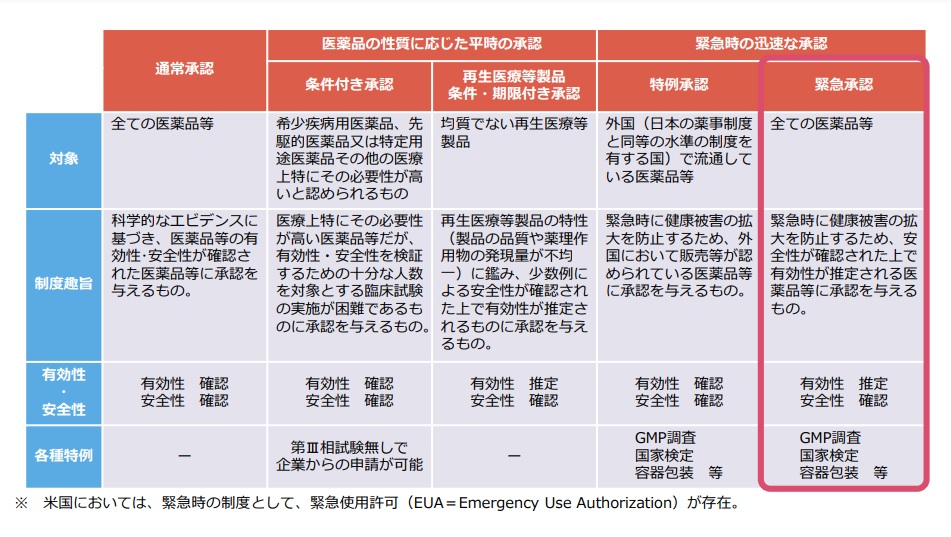
緊急承認制度は、国民の生命及び健康に重大な影響を与えるおそれがある疾病のまん延その他の健康被害の拡大を防止するために緊急に使用されることが必要な医薬品等について、他に代替手段が存在しない場合に、安全性の確認を前提に、医薬品等の有効性が推定されたときに、迅速な薬事承認を与えることができる新たな仕組みです。
緊急時の迅速な薬事承認を可能とするため、GMP調査、国家検定、容器包装等についての特例措置を設け、有効性が推定された段階で承認を行うことから、承認に当たっては、当該承認の対象となる医薬品等の適正な使用の確保のために必要な条件及び短期間の期限を付すこととし、期限内に改めて有効性等の確認を求め、有効性等が確認されなければ、承認を取り消すこととなります。
緊急承認制度では、条件及び期限付きの緊急承認を得たのち、所定の期間内に改めて第14条の承認の申請を行うことが義務付けられています(第14条の2の2第5項)。
参照:
- 令和四年の医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(薬機法)等の一部改正について
- 医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律等の一部を改正する法律(令和4年法律第47号)新旧対照表
- e-GOV: 医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律
- 2022.02.28 首相官邸 健康・医療戦略推進本部 第7回医薬品開発協議会(資料2-4: 緊急時の薬事承認制度について)
- 2021.12.22 厚生労働省 厚生科学審議会 令和3度第3回医薬品医療機器制度部会(資料1: 緊急時の薬事承認の在り方 に関するとりまとめ (案) について; 議事録)
上記のとおり、新設された緊急承認制度では、有効性が推定された段階で行う申請に基づく条件及び期限付きの「緊急承認」を得たのち、所定の期間内に改めて行う申請(第14条の2の2第5項)に基づく承認(本記事では便宜上「本承認」と呼ぶ。)を得ることとなります。
この「緊急承認制度」の施行に伴い、特許権の存続期間の延長登録制度に関連して、延長登録の理由となる処分(特許法第67条第4項に定める「政令で定める処分」)とは「緊急承認」のことなのか「本承認」のことなのかを明確にする必要が生じたため、以下のとおり特許法施行令も改正されました。
2.改正特許法施行令
2022年5月20日の「緊急承認制度」の施行に伴い、同日、特許権の存続期間の延長登録制度に関連する特許法第67条第4項に定める「政令で定める処分」に関する特許法施行令(「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律等の一部を改正する法律の施行に伴う関係政令の整備等に関する政令」)が公布、同日施行となりました。
特許法施行令(昭和三十五年政令第十六号)(抄)(第三条関係)
| 改正後 | 改正前 |
|---|---|
| (特許法第六十七条第四項の延長登録の出願の理由となる処分) 第二条 特許法第六十七条第四項の政令で定める処分は、次のとおりとする。 一 (略) 二 次に掲げる処分 イ 医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(昭和三十五年法律第百四十五号。以下「医薬品医療機器等法」という。)第十四条第一項に規定する医薬品に係る同項の承認 (医薬品医療機器等法第十四条の二の二第五項の申請に基づくものを除く。)、医薬品医療機器等法第十四条第十五項(医薬品医療機器等法第十九条の二第五項において準用する場合を含む。)の承認(医薬品医療機器等法第十四条の二の二第五項(医薬品医療機器等法第十九条の二第五項において準用する場合を含む。)の申請に基づくものを除く。)及び医薬品医療機器等法第十九条の二第一項の承認(同条第五項において準用する医薬品医療機器等法第十四条の二の二第五項の申請に基づくものを除く。) ロ 医薬品医療機器等法第二十三条の二の五第一項に規定する体外診断用医薬品に係る同項の承認(医薬品医療機器等法第二十三条の二の六の二第五項の申請に基づくものを除く。)、医薬品医療機器等法第二十三条の二の五第十五項(医薬品療機器等法第二十三条の二の十七第五項において準用する場合を含む。)の承認(医薬品医療機器等法第二十三条の二の六の二第五項(医薬品医療機器等法第二十三条の二の十七第五項において準用する場合を含む。)の申請に基づくものを除く。)及び医薬品医療機器等法第二十三条の二の十七第一項の承認(同条第五項において準用する医薬品医療機器等法第二十三条の二の六の二第五項の申請に基づくものを除く。) ハ (略) ニ 医薬品医療機器等法第二十三条の二十五第一項の承認(医薬品医療機器等法第二十三条の二十六第五項(医薬品医療機器等法第二十三条の二十六の二第三項において準用する場合を含む。)の申請に基づくものを除く。)、医薬品医療機器等法第二十三条の二十五第十一項(医薬品医療機器等法第二十三条の三十七第五項において準用する場合を含む。)の承認(医薬品医療機器等法第二十三条の二十六の二第三項(医薬品医療機器等法第二十三条の三十七第五項において準用する場合を含む。)において準用する医薬品医療機器等法第二十三条の二十六第五項(医薬品医療機器等法第二十三条の三十七第五項において準用する場合を含む。)の申請に基づくものを除く。)及び医薬品医療機器等法第二十三条の三十七第一項の承認(同条第五項において準用する医薬品医療機器等法第二十三条の二十六第五項(医薬品医療機器等法第二十三条の三十七第五項において準用する医薬品医療機器等法第二十三条の二十六の二第三項において準用する場合を含む。)の申請に基づくものを除く。) | (特許法第六十七条第四項の延長登録の出願の理由となる処分) 第二条 特許法第六十七条第四項の政令で定める処分は、次のとおりとする。 一 (略) 二 次に掲げる処分 イ 医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(昭和三十五年法律第百四十五号。以下「医薬品医療機器等法」という。)第十四条第一項に規定する医薬品に係る同項の承認、同条第十五項(医薬品医療機器等法第十九条の二第五項において準用する場合を含む。)の承認及び医薬品医療機器等法第十九条の二第一項の承認 ロ 医薬品医療機器等法第二十三条の二の五第一項に規定する体外診断用医薬品に係る同項の承認、同条第十五項(医薬品医療機器等法第二十三条の二の十七第五項において準用する場合を含む。)の承認及び医薬品医療機器等法第二十三条の二の十七第一項の承認 ハ (略) ニ 医薬品医療機器等法第二十三条の二十五第一項の承認(医薬品医療機器等法第二十三条の二十六第五項の申請に基づく医薬品医療機器等法第二十三条の二十五第一項の承認を除く。)、医薬品医療機器等法第二十三条の二十五第十一項(医薬品医療機器等法第二十三条の三十七第五項において準用する場合を含む。)の承認及び医薬品医療機器等法第二十三条の三十七第一項の承認(同条第五項において準用する医薬品医療機器等法第二十三条の二十六第五項の申請に基づく医薬品医療機器等法第二十三条の三十七第一項の承認を除く。) |
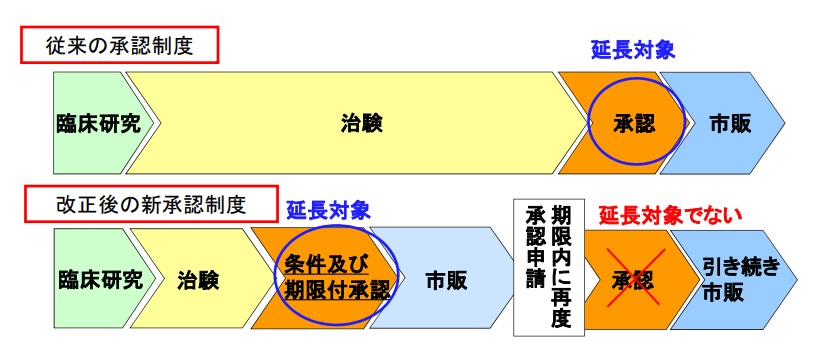
緊急承認(下記図中の①)は、薬機法上の「製造販売の承認」(改正薬機法第14条及び第14条の2の2第1項)であり、これにより特許発明の実施が可能となることから、緊急承認は特許法上の特許発明の実施をするために受けることが必要であった処分に相当します。
したがって、緊急承認制度により、緊急承認(下記図中の①)と緊急承認を受けた後に当該承認の期限内に改めて行う申請(改正薬機法第14条の2の2第5項)に基づく承認(下記図中の②)を受ける場合には、緊急承認を特許権の存続期間の延長登録の理由となる処分とし、改めて行う申請(改正薬機法第14条の2の2第5項)に基づく承認は、特許権の存続期間の延長登録の理由となる処分とならないことを定めています。
- 2022.05.20 特許庁ウェブサイト「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律等の一部を改正する法律の施行に伴う関係政令の整備等に関する政令」より
3.再生医療等製品の「仮承認」を延長登録理由としていることとの整合
2013年11月20日、「薬事法等の一部を改正する法律(平成25年法律第84号)」(薬機法)が成立し、新たに「再生医療等製品」の区分が定義付けられ、「再生医療等製品」には、従来の承認制度に加えて、特定の条件及び期限付きで早期に承認(以下、「仮承認」ともいう。)を与え(第23条の26第1項)、その後の市販で有効性と更なる安全性を検証し、再度の承認(以下、「本承認」ともいう。)を与える(第23条の26第5項)という2段階の承認制度が設けられました(2014年11月25日施行)。
この「再生医療等製品」の条件及び期限付き承認(仮承認)は、有効性の推定とその後の本承認が求められる2段階承認制度であるという点で、「緊急承認」と類似しています(上記の図1(薬事承認制度 の比較)参照)。
- 厚生労働省「薬事法等の一部を改正する法律について」
そして、「再生医療等製品」の条件及び期限付き承認制度が新設された際に、「再生医療等製品」を特許権の存続期間の延長登録制度において延長対象とすること、さらに、「条件及び期限付承認(仮承認)」を延長対象とし、条件及び期限付承認(仮承認)後の再度の承認に基づく承認(本承認)を延長対象としないことについて特許法施行令第3条も改正されました(「薬事法等の一部を改正する法律の施行に伴う関係政令の整備等及び経過措置に関する政令」(2014年7月30日公布、11月25日施行)。
- 2014.10.03 産業構造審議会 知的財産分科会 特許制度小委員会 第2回 審査基準専門委員会ワーキンググループ 議事要旨; 配布資料; 議事録 「議題(3)薬事法改正に伴う「特許権の存続期間の延長」の審査基準の改訂について」より
- 2014.11.19 特許庁「薬事法改正に伴う「特許権の存続期間の延長」の審査基準の改訂について」
- 2014.4.28 経済産業省 規制の事前評価(RIA)「薬事法等の一部改正に伴う特許法施行令改正に係る事前評価書について」要旨; 本文
今回、「緊急承認」を延長登録理由の対象処分とし、その後の「本承認」を対象処分としないとした特許法施行令の改正は、再生医療等製品の「仮承認」を延長登録理由の対象処分とし、その後の「本承認」を対象処分としないとしている特許法施行令の現状とも整合しそうです。


コメント
2022.11.22 塩野義 press release: 新型コロナウイルス感染症(COVID-19)治療薬「ゾコーバ® 錠125mg」の 緊急承認制度に基づく製造販売承認取得について
https://www.shionogi.com/jp/ja/news/2022/11/20221122.html
ゾコーバ錠(エンシトレルビル フマル酸)の特許7105430号の登録は今年7月。
https://www.j-platpat.inpit.go.jp/c1800/PU/JP-7105430/519B4DEDBEADAB4BB60040AB73D489E4C25CA254BB6B3A63E719249209674696/15/ja
塩野義は延長期間が5カ月足らずでも存続期間の延長登録出願をすると考えられます。
初「緊急承認」に基づく延長制度の運用となるとみられ、特許法施行令の改正が役立つことになりそうです。
ゾコーバ錠(エンシトレルビル フマル酸)の特許7105430号について存続期間延長登録出願がされました。
特願2023-700006
出願日 2023年2月14日
延長を求める期間 4月7日
出願人 塩野義製薬株式会社,国立大学法人北海道大学
政令で定める処分の内容
(1)特許権の存続期間の延長登録の理由となる処分
医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律第14条第1項に規定する医薬品に係る同項の承認
(2)処分を特定する番号
承認番号 30400AMX00205000
(3)処分の対象となった物
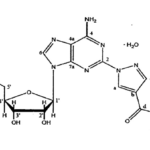
販売名:ゾコーバ錠125mg 一般名:エンシトレルビル フマル酸 化学名:(6E)-6-[(6-クロロ-2-メチル-2H-インダゾール-5-イル)イミノ]-3-[(1-メチル-1H-1,2,4-トリアゾール-3-イル)メチル]-1-[(2,4,5-トリフルオロフェニル)メチル]-1,3,5-トリアジナン-2,4-ジオン一フマル酸
(4)処分の対象となった物について特定された用途
SARS-CoV-2による感染症
ゾコーバ錠(エンシトレルビル フマル酸)の特許7105430号について存続期間延長登録出願が登録されました。
緊急承認に基づく延長制度の初運用事例となります。
パンデミックのような緊急事態が起きないことを祈りつつ、これが良い意味で最初で最後であってほしい・・・
延長登録の年月日 令和05年11月01日
特許番号 7105430
延長の期間 4月7日
特許権者
塩野義製薬株式会社 , 国立大学法人北海道大学
政令で定める処分の内容
(1)特許権の存続期間の延長登録の理由となる処分
医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律第14条第1項に規定する医薬品に係る同項の承認
(2)処分を特定する番号
承認番号 30400AMX00205000
(3)処分の対象となったもの
販売名:ゾコーバ錠125mg
一般名:エンシトレルビルフマル酸
化学名:(6E)-6-[(6-クロロ-2-メチル-2H-インダゾール-5-イル)イミノ]-3-[(1-メチル-1H-1,2,4-トリアゾール-3-イル)メチル]-1-[(2,4,5-トリフルオロフェニル)メチル]-1,3,5-トリアジナン-2,4-ジオン一フマル酸
(4)処分の対象となったものについて特定された用途
SARS-CoV-2による感染症
2024.03.05 塩野義 press release: 新型コロナウイルス感染症(COVID-19)治療薬「ゾコーバⓇ錠125mg」の日本における通常承認の取得について
https://www.shionogi.com/jp/ja/news/2024/03/20240305.html
塩野義製薬株式会社は、COVID-19治療薬「ゾコーバⓇ錠125mg」(一般名:エンシトレルビル フマル酸、以下「ゾコーバⓇ」)について、「SARS-CoV-2による感染症」の適応で日本において緊急承認を取得した後、通常承認申請を実施し、本日付で通常承認を取得しました。