1. レムデシビル(Remdesivir)について
ギリアドのプレスリリースによると、Remdesivir(開発コード: GS-5734)は、エボラウイルス、マールブルグウイルス、MERSウイルス、SARSウイルスを含む、複数のエマージングウイルス病原体に対し、in vitroと動物モデルを用いたin vivoの両方で広範な抗ウイルス活性を有する開発中の核酸アナログであり、これまでに、健常ボランティアとエボラウイルス感染者を対象としたRemdesivirの検討が行われていますが、世界のいずれの国においても認可・承認(licensed or approved)されておらず、いずれの適応でもその安全性や有効性は確立されていないとのことです。
ギリアドは、COVID-19(新型コロナウイルス感染症)と診断された成人を対象として Remdesivir の安全性と有効性を評価することを目的とした第III相臨床試験を開始するためにFDAに治験届を提出(IND)すると発表し(2020年2月26日)、現在、それら試験を実施中です。
ギリアドにより開始された第III相臨床試験:
- Study title: “Study to Evaluate the Safety and Antiviral Activity of Remdesivir (GS-5734™) in Participants With Severe Coronavirus Disease (COVID-19)”
The primary objective of this study is to evaluate the efficacy of 2 remdesivir (RDV) regimens with respect to the normalization of temperature and oxygen saturation through Day 14 in participants with severe coronavirus disease (COVID-19). (ClinicalTrials.gov Identifier: NCT04292899) - Study title: “Study to Evaluate the Safety and Antiviral Activity of Remdesivir (GS-5734™) in Participants With Moderate Coronavirus Disease (COVID-19) Compared to Standard of Care Treatment”
The primary objective of this study is to evaluate the efficacy of 2 remdesivir (RDV) regimens compared to standard of care (SOC), with respect to the time to discharge in participants with moderate coronavirus disease (COVID-19). (ClinicalTrials.gov Identifier: NCT04292730)
また、ギリアドは、政府機関、非政府組織および各国の規制当局と協力し、進行中の臨床試験外の緊急治療を目的とした未承認医薬品の人道的使用をベースとして、適格とされるCOVID-19患者にRemdesivirを提供しているとのことです。ギリアドは、すでに実施中の試験に薬剤を寄付するとともに科学的な情報提供を行っており、中国で先行して実施されている2試験(China-Japan Friendship Hospital主導)については4月に結果が得られる予定のようです(Estimated Primary Completion Date: April 3 or 10, 2020 (Final data collection date for primary outcome measure))。
中国で先行実施されている2試験(China-Japan Friendship Hospital主導):
- Official Title: “A Phase 3 Randomized, Double-blind, Placebo-controlled, Multicenter Study to Evaluate the Efficacy and Safety of Remdesivir in Hospitalized Adult Patients With Severe 2019-nCoVRespiratory Disease.”(ClinicalTrials.gov Identifier: NCT04257656)
- Official Title: “A Phase 3 Randomized, Double-blind, Placebo-controlled Multicenter Study to Evaluate the Efficacy and Safety of Remdesivir in Hospitalized Adult Patients With Mild and Moderate 2019-nCoV Respiratory Disease.” (ClinicalTrials.gov Identifier: NCT04252664)
参考:
- 2020.02.26 Gilead Sciences press release: Gilead Sciences Initiates Two Phase 3 Studies of Investigational Antiviral Remdesivir for the Treatment of COVID-19
- 2020.02.27 ギリアド・サイエンシズ(株) press release: ギリアド・サイエンシズ、COVID-19の治療薬として開発中の抗ウイルス薬であるremdesivirによる2つの第III相試験を開始
- Gilead Sciences, Inc. website: For the latest updates on our ongoing response to COVID-19
- ClinicalTrials.govにてRemdesivirを検索: https://www.clinicaltrials.gov/
2. レムデシビル(Remdesivir)の国際特許出願について
Remdesivir(開発コード: GS-5734)の化学構造式は既に知られています。
- WHO Drug Information, Vol.30,No.4,2016 (Proposed INN: List 116) p668
- Nature. 2016 March 17; 531(7594): 381–385
PATENTSCOPEを利用してRemdesivirの化学構造式から検索し(2020年3月22日時点)、Gilead Sciences, Inc.を出願人とする国際特許出願を下記の表1にリストしました。
表1: Remdesivirに関連するギリアドの国際特許出願
(PATENTSCOPEを利用してRemdesivirの構造式から検索(2020年3月22日時点)。Gilead Sciences, Inc.を出願人とする国際特許出願をピックアップ。)
|
Filing No.
(Filing Date)
|
Publication No.
(Publication Date)
|
Title
|
発明種別
(Remdesivir関連記載)
|
|
PCT/US2018/041482
(10.07.2018)
|
WO2019/014247
(17.01.2019)
|
COMPOSITIONS COMPRISING AN RNA POLYMERASE INHIBITOR AND CYCLODEXTRIN FOR TREATING VIRAL INFECTIONS
|
製剤
(Claim 1等)
|
|
PCT/US2018/029974
(27.04.2018)
|
WO2018/204198
(08.11.2018)
|
CRYSTALLINE FORMS OF (S) 2 ETHYLBUTYL 2 (((S) (((2R,3S,4R,5R) 5 (4 AMINOPYRROLO[2,1-F] [1,2,4]TRIAZIN-7-YL)-5-CYANO-3,4-DIHYDROXYTETRAHYDROFURAN-2 YL)METHOXY)(PHENOXY) PHOSPHORYL)AMINO)PROPANOATE
|
結晶形
(Claim 82等)
|
|
PCT/US2018/022166
(13.03.2018)
|
WO2018/169946
(20.09.2018)
|
METHODS OF TREATING FELINE CORONAVIRUS INFECTIONS
|
用途
(Claim 1等)
|
|
PCT/US2017/028243
(19.04.2017)
|
WO2017/184668
(26.10.2017)
|
METHODS FOR TREATING FLAVIVIRIDAE VIRUS INFECTIONS
|
用途
(Claim 4等)
|
|
PCT/US2016/052092
(16.09.2016)
|
WO2017/049060
(23.03.2017)
|
METHODS FOR TREATING ARENAVIRIDAE AND CORONAVIRIDAE VIRUS INFECTIONS
|
用途
(Claim 25)
|
|
PCT/US2015/057934
(29.10.2015)
|
WO2016/069827
(06.05.2016)
|
METHODS FOR TREATING FILOVIRIDAE VIRUS INFECTIONS
|
用途
(Claim 20等)
|
|
PCT/US2015/057932
(29.10.2015)
|
WO/2016/069825
(06.05.2016)
|
METHODS FOR THE PREPARATION OF RIBOSIDES
|
製法
(Example 12 等)
|
|
PCT/US2011/045102
(22.07.2011)
|
WO/2012/012776
(26.01.2012)
|
METHODS AND COMPOUNDS FOR TREATING PARAMYXOVIRIDAE VIRUS INFECTIONS
|
物質
(Claim 25等)
|
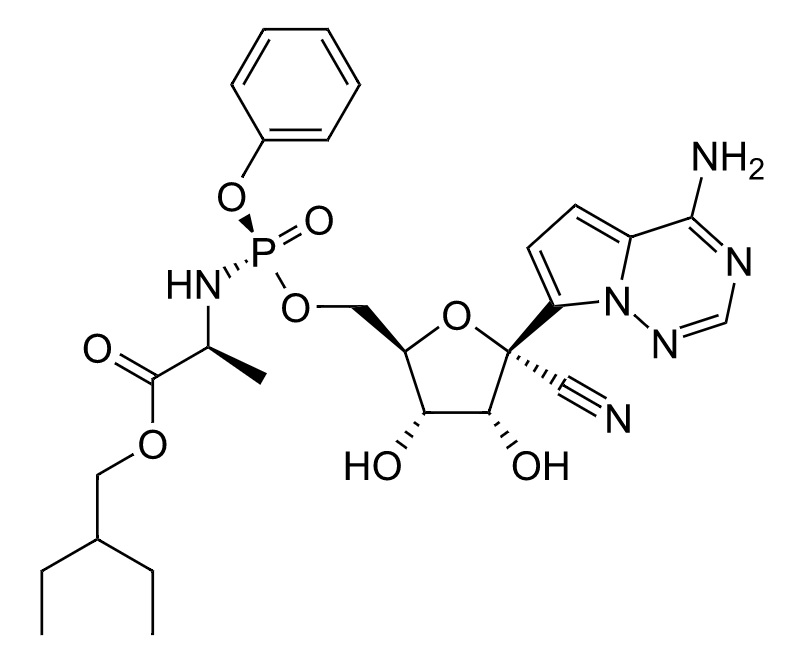
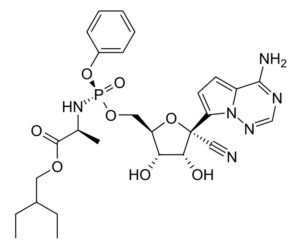
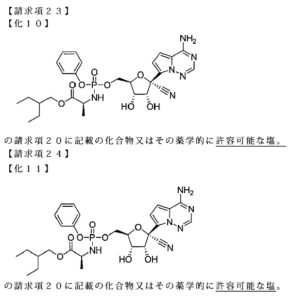
表1のとおり、Gilead Sciences, Inc.を出願人とする国際特許出願は、現時点で、少なくとも8件存在しており、そのうち、最先の国際特許出願PCT/US2011/045102が、Remdesivirを保護する物質特許出願と考えられます。この国際特許出願は、日本への移行手続きがされており、特許第5969471号として登録されました。当該日本特許明細書には、Remdesivirに関連する記載として、段落【0224】に化合物9の製造方法についての一定の記載があり、その化合物9は少なくとも請求項23・24により保護されています。出願日は2011年7月22日ですので、特許期間延長登録出願がされていない現時点での当該日本特許権の存続期間満了日は出願日から20年後の2031年7月22日となります。
Espacenetによるpatent searchで当該国際特許出願(PCT/US2011/045102)のpatent familyを検索すると、当該出願は日本を含む多くの国々で国内移行手続きがされていることが分かります。例えば、中国にも手続きされて審査が進み、特許として登録(CN103052631B)されていることが分かります。

コメント
2020年5月7日、ギリアド・サイエンシズ(株)は、レムデシビルを有効成分とする「ベクルリー® 点滴静注液 100 mg(水性注射液)およびベクルリー®点滴静注用 100 mg(注射用凍結乾燥製剤)」について「SARS-CoV-2 による感染症」を効能・効果とする製造販売承認を取得した。
PCT/US2015/057933が漏れていた・・・
PCT/US2015/057932とPCT/US2015/057934のpatent family。日本では特許6220484号として登録。
Govt Urged to Revoke Patent for Gilead’s Potential Anti-COVID19 Drug Remdesivir
https://spicyip.com/2020/04/govt-urged-to-revoke-patent-for-gileads-potential-anti-covid19-drug-remdesivir.html
InPassで確認・・・
http://ipindiaservices.gov.in/publicsearch/
PCT/US2011/045102が物質クレーム(claim 1)で昨年9月に登録(Patent No.319927)されている。その上、さらにPCT/US2015/057933も物質クレーム(claim 2)で登録(Patent No.332280)されるとは・・・
レムデシビルの物質特許は日本も同様・・・第5969471号のほか、さらにPCT/US2015/057933でも拒絶理由通知受けることなく物質クレームで登録されている(第6220484号)。